室温下,将200mL某盐酸和硫酸的混合溶液分成两等分.一份加入过量BaCl2溶液,充分反应后得沉淀4.66g;另一份加入100mL2.0mol•L-1NaOH溶液,充分反应后溶液中氢氧根离子浓度为0.2mol•L-1(溶液的体积为200mL).试计算:原混合溶液中盐酸的物质的量浓度为______mol•L-1.
室温下,将200mL某盐酸和硫酸的混合溶液分成两等分.一份加入过量BaCl2溶液,充分反应后得沉淀4.66g;另一份加入100mL2.0mol•L-1NaOH溶液,充分反应后溶液中氢氧根离子浓度为0.2mol•L-1(溶液的体积为200mL).试计算:原混合溶液中盐酸的物质的量浓度为______mol•L-1.
发布时间:2025-03-11 09:19:24
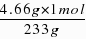 =0.02mol,故每份溶液中所含H2SO4的物质的量为0.02mol;强酸和氢氧化钠反应的离子方程式为H OH-=H2O,参加反应OH-的物质的量为:2mol/L×0.1L-0.2mol/L×0.2L=0.16mol,则每份混酸中n(H )=n(OH-)=0.16mol,每份中n(HCl)=
=0.02mol,故每份溶液中所含H2SO4的物质的量为0.02mol;强酸和氢氧化钠反应的离子方程式为H OH-=H2O,参加反应OH-的物质的量为:2mol/L×0.1L-0.2mol/L×0.2L=0.16mol,则每份混酸中n(H )=n(OH-)=0.16mol,每份中n(HCl)=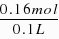 =1.6mol/L,溶液具有均一性,则原混合溶液中盐酸的物质的量浓度为1.6mol/L,故答案为:1.6.
=1.6mol/L,溶液具有均一性,则原混合溶液中盐酸的物质的量浓度为1.6mol/L,故答案为:1.6.

