- 首页
- 教师继续教育
答案:
[答案] (1). 30℃ (2). 2.0h (3). MnO2 (4). 将Fe2 氧化为Fe3 (5). 调节pH将Fe3 转化为沉淀除去 (6). Zn Cu2 =Zn2 Cu (7). [Zn(OH)4]2− 2e−=Zn 4OH− (8). Zn3CO3(OH)4[解析][分析]锌灰(主要成分为ZnO、PbO、FeO、MnO2、CuO)加入稀盐酸酸浸,MnO2不溶液于稀盐酸,过滤后得到的滤渣1为MnO2,滤液中含有Zn2 、Fe2 、Cu2 、Pb2 等,加入H2O2可氧化溶液中的Fe2 生成Fe3 ,发生H2O2 2Fe2 2H =2Fe3 2H2O,加入ZnO调节溶液pH除去Fe3 ,过滤后滤渣2为Fe(OH)3,滤液中含有等Zn2 、Cu2 、Pb2 等,加入Zn置换出Cu、Pb,经过滤后滤液中主要含有Zn2 ;(1)根据表格中数据,确定“浸取”实验中,锰脱除效果最佳时反应体系的温度、反应时间;(2)酸浸时,锌灰中ZnO、PbO、FeO、CuO均溶于稀盐酸,而MnO2不溶于稀盐酸;(3)H2O2溶液有强氧化性,能氧化溶液中的Fe2 ;Fe3 在溶液中易水解,加入ZnO能促进Fe3 水解;在含有Cu2 、Pb2 的溶液中加入Zn,可置换出Cu和Pb;(4)石墨作电极电解时,阳极氢氧根离子失电子,阴极上[Zn(OH)4]2-得电子;(5)浓硫酸增重为分解生成水的质量,碱石灰增重为分解得到二氧化碳的质量,结合原子守恒计算碳酸根、氢氧根的物质的量,再结合电荷守恒计算Zn2 的物质的量,计算x、y、z的比例关系确定化学式。[详解](1)结合温度、时间对锰脱除效果的影响数据,可知温度为30℃、时间为2小时时除锰率最高,故答案为:30℃;2.0h;(2)含MnO2的锌灰用稀盐酸溶解时,MnO2不溶于稀盐酸,经过滤可除去,即滤渣1为MnO2;(3)向含有Zn2 、Fe2 、Cu2 、Pb2 的滤液中,加入H2O2可氧化溶液中的Fe2 生成Fe3 ;向含Fe3 的溶液中加入ZnO,调节溶液pH,促进Fe3 水解生成Fe(OH)3沉淀除去;在含有Cu2 、Pb2 的溶液中加入Zn,可置换出Cu和Pb,发生的离子反应包括:Zn Pb2 =Pb Zn2 、Zn Cu2 =Zn2 Cu,所以答案为:将Fe2 氧化为Fe3 ;调节pH将Fe3 转化为沉淀除去;Zn Cu2 ═Zn2 Cu;(4)石墨作电极电解时,阳极氢氧根离子失电子生成O2,阴极上[Zn(OH)4]2-得电子生成Zn,则阴极的电极方程式为:[Zn(OH)4]2- 2e--=Zn 4OH-;(5)浓硫酸增重为分解生成水的质量,水的物质的量为n(H2O)=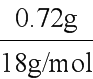 =0.04mol,则n(OH-)=0.08mol,碱石灰增重为分解得到CO2的质量,CO2物质的量为n(CO2)=
=0.04mol,则n(OH-)=0.08mol,碱石灰增重为分解得到CO2的质量,CO2物质的量为n(CO2)= =0.02mol,则n(CO32-)=0.02mol,结合原子守恒,可知(Zn2 )=
=0.02mol,则n(CO32-)=0.02mol,结合原子守恒,可知(Zn2 )= ×(0.08mol 0.02mol×2)=0.06mol,则x:y:z=0.06:0.02:0.08=3:1:4,故该碱式碳酸锌的化学式为:Zn3CO3(OH)4。[点睛]本题考查物质的制备的知识,涉及电解池、元素化合物性质、离子检验、沉淀转化、化学工艺流程、物质的分离提纯、物质组成测定等,需要学生具备扎实的基础与灵活运用的能力。
×(0.08mol 0.02mol×2)=0.06mol,则x:y:z=0.06:0.02:0.08=3:1:4,故该碱式碳酸锌的化学式为:Zn3CO3(OH)4。[点睛]本题考查物质的制备的知识,涉及电解池、元素化合物性质、离子检验、沉淀转化、化学工艺流程、物质的分离提纯、物质组成测定等,需要学生具备扎实的基础与灵活运用的能力。

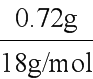 =0.04mol,则n(OH-)=0.08mol,碱石灰增重为分解得到CO2的质量,CO2物质的量为n(CO2)=
=0.04mol,则n(OH-)=0.08mol,碱石灰增重为分解得到CO2的质量,CO2物质的量为n(CO2)= =0.02mol,则n(CO32-)=0.02mol,结合原子守恒,可知(Zn2 )=
=0.02mol,则n(CO32-)=0.02mol,结合原子守恒,可知(Zn2 )= ×(0.08mol 0.02mol×2)=0.06mol,则x:y:z=0.06:0.02:0.08=3:1:4,故该碱式碳酸锌的化学式为:Zn3CO3(OH)4。[点睛]本题考查物质的制备的知识,涉及电解池、元素化合物性质、离子检验、沉淀转化、化学工艺流程、物质的分离提纯、物质组成测定等,需要学生具备扎实的基础与灵活运用的能力。
×(0.08mol 0.02mol×2)=0.06mol,则x:y:z=0.06:0.02:0.08=3:1:4,故该碱式碳酸锌的化学式为:Zn3CO3(OH)4。[点睛]本题考查物质的制备的知识,涉及电解池、元素化合物性质、离子检验、沉淀转化、化学工艺流程、物质的分离提纯、物质组成测定等,需要学生具备扎实的基础与灵活运用的能力。
