5.6gFe和一定量的稀硝酸恰好完全反应,生成一氧化氮气体,反应后的溶液加入0.25moL的氢氧化钠恰好使铁离子完全沉淀,(1)则参加反应的硝酸的物质的量为______(2)写出总反应的离子方程式______.
5.6gFe和一定量的稀硝酸恰好完全反应,生成一氧化氮气体,反应后的溶液加入0.25moL的氢氧化钠恰好使铁离子完全沉淀,(1)则参加反应的硝酸的物质的量为______(2)写出总反应的离子方程式______.
发布时间:2025-03-12 23:02:30
5.6gFe和一定量的稀硝酸恰好完全反应,生成一氧化氮气体,反应后的溶液加入0.25moL的氢氧化钠恰好使铁离子完全沉淀,(1)则参加反应的硝酸的物质的量为______(2)写出总反应的离子方程式______.
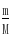 =
=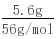 =0.1mol,假设铁与硝酸反应生成的是Fe(NO3)2,Fe(NO3)2与氢氧化钠反应生成氢氧化亚铁需要氢氧化钠的物质的量为0.2mol;假设铁与硝酸反应生成的是Fe(NO3)3,Fe(NO3)3与氢氧化钠反应生成氢氧化铁需要氢氧化钠的物质的量为0.3mol;实际使用了0.25moL氢氧化钠,所以铁与硝酸反应的产物有硝酸铁和硝酸亚铁.利用十字相乘法计算硝酸铁和硝酸亚铁的物质的量之比.
=0.1mol,假设铁与硝酸反应生成的是Fe(NO3)2,Fe(NO3)2与氢氧化钠反应生成氢氧化亚铁需要氢氧化钠的物质的量为0.2mol;假设铁与硝酸反应生成的是Fe(NO3)3,Fe(NO3)3与氢氧化钠反应生成氢氧化铁需要氢氧化钠的物质的量为0.3mol;实际使用了0.25moL氢氧化钠,所以铁与硝酸反应的产物有硝酸铁和硝酸亚铁.利用十字相乘法计算硝酸铁和硝酸亚铁的物质的量之比.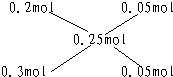 所以硝酸亚铁与硝酸铁的物质的量之比为0.05mol:0.05mol=1:1.故铁原子守恒知,有一半的铁生成硝酸亚铁,一半的铁生成硝酸铁.(1)Fe 4HNO3=Fe(NO3)3 NO↑ 2H2O 1mol 4mol 0.05mol 0.2mol3Fe 8HNO3=3Fe(NO3)2 2NO↑ 4H2O3mol 8mol0.05mol
所以硝酸亚铁与硝酸铁的物质的量之比为0.05mol:0.05mol=1:1.故铁原子守恒知,有一半的铁生成硝酸亚铁,一半的铁生成硝酸铁.(1)Fe 4HNO3=Fe(NO3)3 NO↑ 2H2O 1mol 4mol 0.05mol 0.2mol3Fe 8HNO3=3Fe(NO3)2 2NO↑ 4H2O3mol 8mol0.05mol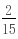 mol 所以硝酸的用量为 0.2mol
mol 所以硝酸的用量为 0.2mol 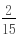 mol=
mol=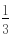 mol,故答案为:
mol,故答案为: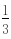 mol;(2)铁为单质写化学式,一氧化氮是气体写化学式,水是弱电解质写化学式,硝酸、硝酸盐是可溶性强电解质写离子.故答案为:6Fe 20H 5NO3-═3Fe2 3Fe3 5NO↑ 10H2O.
mol;(2)铁为单质写化学式,一氧化氮是气体写化学式,水是弱电解质写化学式,硝酸、硝酸盐是可溶性强电解质写离子.故答案为:6Fe 20H 5NO3-═3Fe2 3Fe3 5NO↑ 10H2O.
